
KIT22.4.20242"
Ein komplexes Netzwerk aus Blutgefässen verteilt das Blut über alle Organe des Körpers und gewährleistet so, dass die Körperzellen mit genügend Sauerstoff und Nährstoffen versorgt werden, um beispielsweise den Herzschlag und die Gehirnfunktion aufrechtzuerhalten. Verstopfungen von Blutgefässen und damit Beeinträchtigungen der Sauerstoffzufuhr können zu neuronalem oder kardialem Zelltod führen und in einem Schlaganfall oder Herzinfarkt gipfeln. Die Revaskularisierung erfordert funktionelle Blutgefässe. Wie diese Revaskularisierung von Organen tatsächlich abläuft und wie sie gefördert werden kann, ist noch immer ein ungelöstes klinisches Problem.
Da jedes Organ eine einzigartige physiologische Funktion erfüllt, unterscheiden sich die vaskulären Verzweigungsmuster zwischen den Organen. Wie organspezifische vaskuläre Strukturen entstehen, war lange Zeit ein Rätsel. Aus therapeutischer Sicht wird angenommen, dass das grundlegende Verständnis der organspezifischen molekularen Steuerung des Gefässwachstums und der Gefässverzweigungen einen Schlüssel für die Entwicklung personalisierter Medizinstrategien zur Bekämpfung von Herz-Kreislauf- und neurodegenerativen Erkrankungen bietet.
Pionierzellen bewegen sich innerhalb der Gefässwände
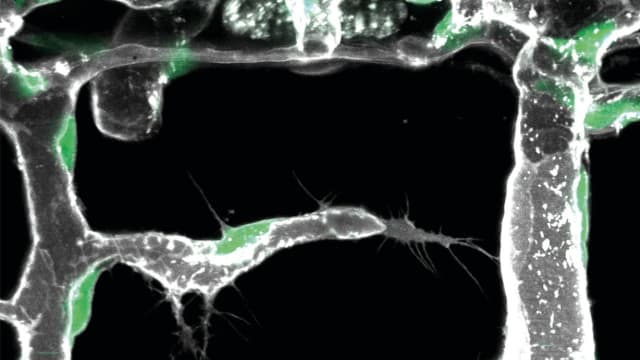
Wissenschaftler um Professor Ferdinand le Noble, Leiter der Abteilung Zell- und Entwicklungsbiologie am Zoologischen Institut des KIT, haben nun entdeckt, dass die Aktivierung eines neuen vaskulären Zelltyps ein entscheidendes Element der organabhängigen Variabilität in der vaskulären Verzweigung darstellt. Diesen Zelltyp nennen sie sie Endotheliale L-Spitzenzelle oder Pionierzelle. Pionierzellen befinden sich innerhalb der inneren Schicht, die das Blutgefäss auskleidet, dem sogenannten Endothel.
Unter Verwendung hochmoderner Bildgebungstechniken fanden die Forscher heraus, dass sich Pionierzellen innerhalb der Gefässwand bewegen. Sobald sie mit spezifischen, von der lokalen Umgebung produzierten Signalen in Kontakt kommen, beginnen diese Pionierzellen, neue Blutgefässe zu bilden. Um die molekulare Identität dieser Signale zu klären, die signalproduzierenden Zellen zu identifizieren und vor allem auch den Mechanismus, wie diese Signale wahrgenommen werden, um die Differenzierung von Pionierzellen fördern, verwendeten die Wissenschaftler die kürzlich entwickelte Technik der Einzelzell-Sequenzierung.
Molekülcocktail codiert Ort und Zeit der Bildung von Blutgefässen
«Die Einzelzell-Sequenzierung kombiniert detaillierte RNA-Sequenzierung einzelner Zellen mit bioinformatischen Analysen und ermöglicht eine präzise Identifizierung von Zellsubtypen und den Molekülen, die diese Zellen für die Zell-Zell-Kommunikation synthetisieren», erklärt Dr. Laetitia Préau, Erstautorin der Studie. «Mit dieser Technik haben wir entdeckt, dass die vaskuläre Musterung durch eine spezifische Reihe von Molekülen codiert wird, die nur von einer Untergruppe von Endothelzellen wahrgenommen werden können, um das Gefässwachstum zu fördern.»
Dieser Molekülcocktail ist organspezifisch und codiert die Anleitung dafür, wie an diesem bestimmten Ort und zu diesem bestimmten Zeitpunkt ein neues Blutgefäss gebildet werden kann. Als Empfänger dieses molekularen Codes dienen ausschliesslich die zukünftigen Pionierzellen, die den Code entschlüsseln und vaskuläre Wachstumsprozesse einleiten.
Grundlagen für neue Therapieansätze
Dabei stellte sich heraus, dass mehrere dieser organspezifischen vaskulären Wachstumscode-Moleküle potenziell pharmakologisch manipulierbar sind. Professor Ferdinand le Noble verdeutlicht: «Um die therapeutischen Möglichkeiten zu erkunden, arbeiten wir in unserem 3R Center 3ROCKIT des KIT-Zentrums Health Technologies (KITHealthTech) mit Experten aus Chemie, Gewebeingenieurwesen (Tissue Engineering) und KI zusammen. Wir hoffen, neuartige intelligente Moleküle zu identifizieren, um den vaskulären Wachstumsprozess zu beeinflussen, was Patienten mit ischämischen Herz-Kreislauf-Erkrankungen wie Herzinfarkt und Schlaganfall sowie bestimmten Krebsformen zugutekommen könnte.»PS
just-medical!
Blegistrasse 5
6340 Baar
Schweiz
www.just-medical.com
Kontakt
info@docinside.ch
+41 41 766 11 55
+41 41 766 11 55
Redaktionelle Leitung:
Dr. phil. des. Sarah Bourdely
sarah.bourdely@medinside.ch
sarah.bourdely@medinside.ch
Anmelden und kostenlos alle Tools nutzen
Entdecken Sie das gesamte Angebot (z.B. Scores, Guidelines, Veranstaltungen, Drugshortages, Cochrane Library, Compendium)







